




Kondo Lab の研究内容

英国時代の仕事
我々は1997年にp97ATPaseの最初の補因子として新規蛋白質p47を発見したが、これがゴルジ体・小胞体の形成に必須の細胞内膜融合機構p97/p47経路の始まりである(1)。次に、試験管内ゴルジ体再構成系(上の図を参照)を用いて、p97/p47の細胞内膜上の最初の受容体syntaxin5を発見し、膜融合複合体p97/p47はp47を介して受容体syntaxin5と直接結合することを示した(2)。
その後にケンブリッジ大学で独立してから、p97経路の新たな必須因子として新規蛋白質VCIP135を発見し、そのcDNAをクローニングした(3)。VCIP135は、ATP依存的にp97/p47/syntaxin5複合体を解離するが、同時に脱ユビキチン酵素としても働くことが分かった。
これら一連のp97ATPaseによる膜融合経路における必須因子の単離同定の仕事に加えて、このp97/p47膜融合経路の細胞周期調節についても明らかにしている。細胞分裂期に特異的なp47のリン酸化を見いだし、それが細胞分裂期におけるゴルジ体の小胞化を引き起こしていることを明らかにした(4)。さらに、そのp47のリン酸化部位を変異させることにより、哺乳類細胞において細胞分裂期でもゴルジ体の層板構造を保つことに世界に先駈けて成功し、ゴルジ体の娘細胞への均等分配にはその小胞化が必ずしも必要でないことを明らかにしている。この過程で同時に分かったのは、興味深いことに、この1997年に我々が発見したp97/p47経路というのが、細胞分裂期終期における娘細胞での細胞内小器官の再構成に特化した細胞内膜融合機構であるということであった。

日本に帰国して、そしてこれから
そこでケンブリッジ大学から三菱化学生命科学研究所にラボを移した後に、これらの成果を基にして、細胞周期間期でのゴルジ体や小胞体の維持に働く新規膜融合経路を探索した。その結果、幸いにもこの程に新規の細胞内膜融合機構p97/p37経路を発見することが出来た(5)。このもう一つのp97ATPaseによる膜融合機構に辿り着くのに、p97/p47経路の発見から数えてまさに10年の年月を要したことは、正直に言って自分自身の中では非常に感慨深いものがある。ついでに付け加えると、このp37のネーミングであるが、私の出身地・名古屋で盛んなパチンコで言うところの「大当たりのトリプル7」に因んでいる(p97, p47, p37)。
余談はさておき、この新規膜融合機構p97/p37経路は、狙ったとおりでゴルジ体・小胞体の細胞周期間期での維持に必須の細胞内膜融合機構であった。この新規膜融合経路の分子機構は、先に我々が発見したp97/p47経路とは幾つかの重要な点で異なっていた。例えば、受容体としてsyntaxin5ではなくてGS15を必要とすること。さらに、VCIP135を必要とするものの、その脱ユビキチン化活性は新経路では必要ではなかった。
現在は、さらにp97膜融合機構の数種類の新規必須因子を単離同定しており、その機能解析に取りかかっている。加えて、研究対象をゴルジ体・小胞体から核膜まで広げつつある。
我々の仕事のもう一つの特徴として、結晶解析グループ(英国Imperial CollegeのPaul Freemontグループ)との密な共同研究がある。我々が新規因子を単離すると、論文発表前に彼らがその蛋白質因子の構造解析に取りかかってくれる。そうすると、我々はその構造解析データを参考にして、さらに別の新規因子の同定に取りかかるという素晴らしい好循環が続いている。その結果は既に幾つかの業績となって出ている(6-8)。

文中で引用した我々の論文
1.Nature 388, 75-8, 1997
2.Cell 92, 603-10, 1998
3.J Cell Biol 159, 855-66, 2002
4.J Cell Biol 161, 1067-79, 2003
5.Developmental Cell 11, 803-816, 2006
6.EMBO J 23, 1030-1039, 2004
7.EMBO J 23, 1463-1473, 2004
8.EMBO J 25,1967-1976, 2006
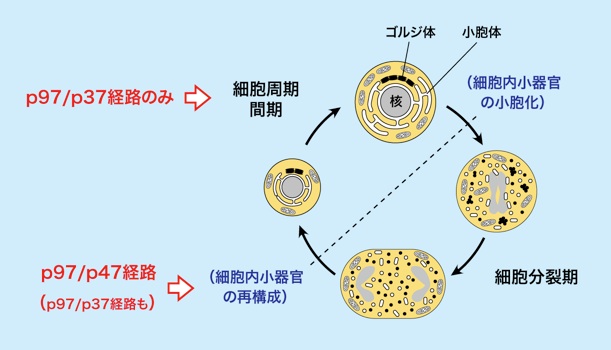
細胞分裂期には細胞内小器官が小胞化します。細胞質分裂により細胞が二つに分裂した後に、小胞化した細胞内小器官は娘細胞に均等分配されて、その娘細胞にて小胞が融合して細胞内小器官が再構成されます。細胞分裂する毎に、このような細胞内小器官の小胞化ー再構成が繰り返されます。
この細胞分裂期における細胞内小器官の再構成に特化した細胞内膜融合機構としてp97/p47経路があります。それとは別に細胞周期間期での細胞内小器官の維持のためにp97/p37経路があります。

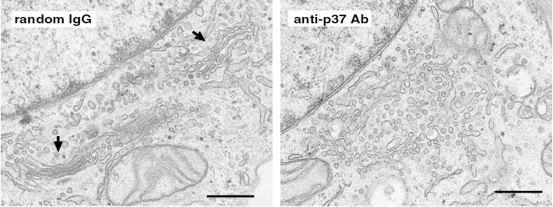
細胞周期の間期の状態である細胞にp37に対する抗体を注入し、細胞内のp37の働きを阻害して、細胞内小器官であるゴルジ体の構造を電子顕微鏡で調べた結果です。対照となる抗体を注入した細胞(左側)に対して、p37に対する抗体を注入した細胞(右側)では、ゴルジ体に特徴的な平たいディスク状の膜が幾層にも重なった構造(左側の矢印部分)が見られなくなっています。これから細胞周期間期でのゴルジ体の維持にp37は重要であることが分かります。図中のバーは0.5マイクロメーターを表します。
このように細胞周期での各時期に於ける機能を検討する実験では、直ぐに効果が現れる抗体の細胞内微量注入は非常に有効です。siRNAなどでは間期と分裂期での機能を分けて検討することは出来ません。ただ、マイクロインジェクションした一つの細胞の形態を電子顕微鏡で観察するのは結構難しく職人芸を要します。この技術を持つラボは世界でも我々の所を含めて数カ所しか有りません。
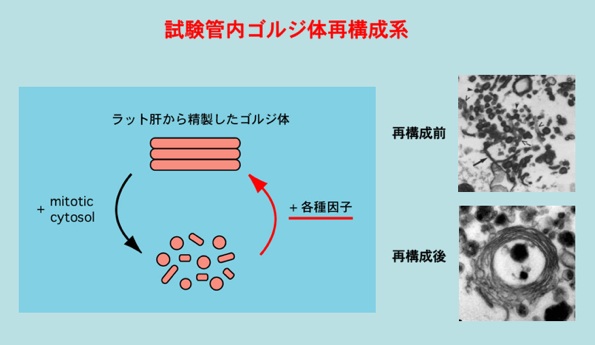
ラット肝臓から高度に精製したゴルジ体を、HeLa培養細胞を細胞分裂期に同調して作った細胞分裂期上清(mitotic cytosol)と試験管内で37Cで培養すると、ゴルジ体の扁平膜積層構造は失われて小胞化する(右上の電顕写真)。
このゴルジ体小胞に各種因子を加えてATP存在下で37Cで培養すると、試験管内でゴルジ体の扁平膜積層構造を再構成することが出来る(右下の電顕写真)。
この試験管内でのゴルジ体の再構成系を用いて、現在まで多くのp97ATPaseによる膜融合の必須因子を同定してきた。
因みに、このアッセイが出来るのは我々のラボを含めて世界で2カ所だけ。
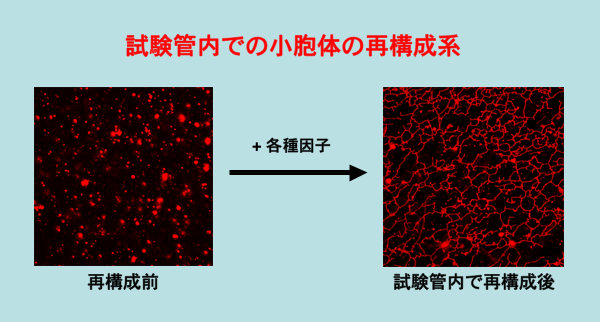
現在は、試験管内ゴルジ体再構成系に加えて、試験管内で小胞体の網状構造を再構成するという我々独自の系も立ち上げている。これを用いて、小胞体の網状構造の形成に必須の因子群を次々と単離している。

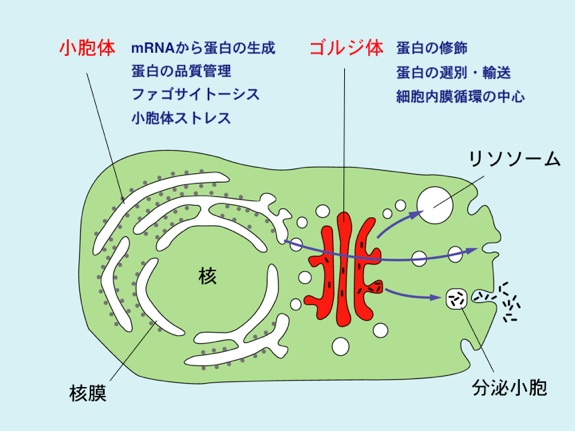
小胞体はmRNAから蛋白質の作られる場であり、生成蛋白質の品質管理の拠点でもある。小胞体で作られた蛋白質はゴルジ体に送られ、そこで修飾・選別された後に種々の目的地へ送り出されている。それら細胞内小器官の形態は大変に特徴的で、小胞体は網状構造を、ゴルジ体は扁平膜積層構造をとる。
まえおき
細胞内小器官は真核細胞に課せられた複雑な機能を分散管理している。こうした細胞のサブシステムとしての細胞内小器官がどのように構築され,機能し,維持されていくかという問題は,細胞生物学の中心的課題であるとともに,ゲノム/タンパク質の研究と動植物の高次機能の研究を接続する重要な役割を果たす。細胞内小器官の適切な構築は細胞機能に必須のプロセスであり,そのメカニズム解明をすすめていくならば,必ずや病気や老化等との関連が出てくるであろうと考えられる。 そのような考えを元に、我々はこの10年以上に渡り、一貫して細胞内小器官ゴルジ体や小胞体・核膜の形成維持に必要な分子機構を研究してきた。
我々の興味は大きく分けると三つある。
1.細胞内小器官の特徴的構造を形成維持する分子機構
2.細胞内小器官の特徴的構造が何故にその機能のために必要であるのか?
3.様々な生理的・病理的条件下において細胞内小器官の構造異常が起こる
が、 その分子機構と生理的・病態生理的意義の解明